Accident radiologique : trier des victimes grâce aux analyses
Après un accident radiologique, le tri des victimes doit être rapide. Un nouveau protocole est utilisé pour analyser plusieurs centaines d’échantillons de sang en un temps réduit. Visite au Laboratoire de radiobiologie des expositions accidentelles (LRACC), dans les Hauts-de-Seine.

Un accident radiologique fictif vient de se produire. Ce 24 juin 2022 à Fontenay-aux-Roses dans les Hauts-de-Seine, le Laboratoire de radio- biologie des expositions accidentelles (LRACC) réceptionne les échantillons de sang de victimes potentiellement irradiées. Huit techniciens et chercheurs sont à pied d’œuvre. Il faut aider les médecins à prioriser et orienter les prises en charge. L’occasion de tester un protocole de crise développé depuis deux ans pour analyser jusqu’à 320 échantillons en dix jours. L’objectif est de fonctionner en mode ré- flexe, tout en minimisant le risque d’erreur.
Deux laboratoires équipés de quatre postes de sécurité microbiologique sont dédiés à la manipulation des échantillons sanguins. Un autre, doté de quatre enceintes chimiques ventilées et huit paillasses expérimentales, prépare les lames pour la microscopie.
Chromosomes : dégâts analysés
Rapidement, les tubes de sang sont déballés et étiquetés. Ce suivi strict garantit la traçabilité des résultats.
Dans une chorégraphie minutieuse, chacun récupère son matériel et rejoint son poste de travail. Quatre binômes enchaînent les huit étapes de traitement des échantillons, depuis leur réception jusqu’à leur classification en niveau de gravité. « Éviter de se marcher sur les pieds est essentiel pour la qualité des opérations », sourit Pascale Fernandez, spécialiste en dosimétrie et technicienne référente, en s’installant devant une paillasse garnie de réactifs préparés en amont. « Ils sont pré-dosés, des “fiches-réflexes” stipulent les quantités à utiliser à chaque étape pour éviter les calculs dans l’urgence, pouvant être source d’erreur, détaille-t-elle. Toutes les machines sont pré-calibrées afin d’être opérationnelles le jour J : incubateur à 37 °C, centrifugeuses, etc. »
Les échantillons sont placés dans un milieu de culture pendant deux jours. L’objectif est de stimuler la croissance des lymphocytes. Ces cellules sanguines jouent un rôle majeur dans le système immunitaire et le test repose sur l’évaluation des dégâts engendrés par les radiations sur leur matériel génétique.
Cinq niveaux de gravité
Trois jours plus tard, l’analyse débute. La technicienne répartit quelques gouttes de solution contenant des cellules apprêtées pour l’analyse sur des lames de verre. Elle les glisse par huit sous un microscope automatique de pointe, fonctionnant à la lumière transmise et équipé d’un support de lame motorisé. « Notre laboratoire en compte quatre, ce qui confère une capacité d’analyse unique en France », se félicite la spécialiste.
Trente-deux lames sont analysées quotidiennement pendant dix jours. L’obtention des résultats est semi-automatique. Un logiciel décrypte les images provenant du microscope. Il identifie les chromosomes et leurs éventuelles aber- rations, des cassures, suivies éventuelle- ment de recompositions anormales.
« Chaque détection automatique est vérifiée par un technicien qualifié », précise Pascale Fernandez. À terme, le laboratoire améliorera la fiabilité et la rapidité grâce à l’intelligence artificielle (IA). C’est l’objectif du projet Increased, mené avec l’Institut national de recherche en sciences et technologies du numérique (Inria). Des images d’aberrations chromosomiques accumulées par le laboratoire serviront à entraîner un nouveau logiciel basé sur l’IA. De quoi mettre à profit vingt ans d’expertise et de recherche en dosimétrie biologique. « Notre base de données est l’une des plus fournies au monde. Elle contient plus de 80 000 images annotées par des experts ! »
À l’issue de ces analyses, le niveau de l’irradiation est déduit du nombre d’aber- rations chromosomiques relevé pour un nombre donné de lymphocytes.
Les patients sont classés en cinq catégories de gravité croissante : sans risque vital immédiat, risque léger, modéré, sévère, très sévère. « Cette démarche oriente leur traitement. Elle est très utile, notamment en absence de symptôme immédiatement visible, comme des lésions cutanées ou des vomissements », souligne la spécialiste.
Le prochain exercice réel aura lieu en 2023 et visera la prise en charge simultanée de 160 échantillons.
Les échantillons sont mis en culture
Bruno Lhomme, technicien au LRACC, place des échantillons de sang dans un milieu de culture ad hoc. L’opération favorise la croissance des lymphocytes, en vue de l’analyse de leur matériel génétique. Les échantillons sont ensuite placés dans un incubateur qui les maintient à 37 °C pendant 46 heures.

Les cellules sanguines sont fixées
À la sortie de l’incubateur, Juan Martinez, chercheur, ajoute à l’échantillon un cocktail de réactifs chimiques pour éliminer les impuretés du milieu réactionnel et « fixer » les chromosomes. Ceci assure un bon espacement entre eux et optimise leur visibilité ultérieure au microscope.

Les lames sont préparées
Après l’étalement sur lame de microscopie de la solution enrichie en lymphocytes, il faut procéder à la coloration des chromosomes. Ne pouvant être conservés, les échantillons sont traités immédiatement. Seules les lames et les images de microscopie sont archivées. Éric Grégoire, chercheur, archive les lames.
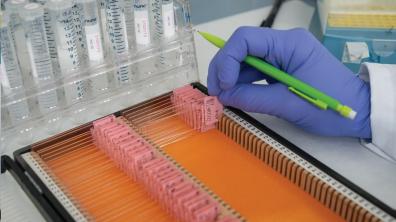
L’analyse peut débuter
Les techniciens vérifient les aberrations chromosomiques repérées par un logiciel de traitement d’images. Leur nombre renseigne sur la dose de radiation reçue. Chaque expert du laboratoire passe, une fois par an, un test certifiant sa capacité à repérer ces anomalies. Les cinq catégories de résultats – sans risque vital immédiat, risque léger, modéré, sévère, très sévère – guident les médecins.

Dans l’intimité des chromosomes
L’analyse de cet échantillon de sang révèle un chromosome dicentrique – ayant deux centres –, une structure anormale résultant d’un événement de réparation erronée de l’ADN. Les analyses peuvent révéler d’autres défauts : anneau – extrémités fusionnées – ou fragment chromosomique.

Pour aller plus loin
https://www.irsn.fr/recherche/laboratoire-radiobiologie-expositions-acc…
Reportage photo : © Sylvain Renard / Médiathèque IRSN
Article publié en janvier 2023

