Séquelles de la radiothérapie : quelles sont les recherches menées sur le microbiote ?
À la suite d’une radiothérapie pour un cancer pelvien, 90 % des patients souffrent de complications gastro-intestinales qui altèrent leur qualité de vie. Une option thérapeutique consiste à agir sur le microbiote intestinal, ensemble de micro-organismes présents naturellement dans le tube digestif. Pour limiter ou soigner les lésions, des scientifiques de l’IRSN mènent des recherches. Des travaux montrent l’impact des rayonnements sur le microbiote et le rôle protecteur de certaines bactéries sur les atteintes de l’épithélium intestinal.

Quatre-vingt-dix pour cent des patients traités par une radiothérapie pour un cancer pelvien souffrent de désordres fonctionnels digestifs causés par l’irradiation de cette zone. Leur qualité de vie est dégradée. Quel rôle joue le microbiote dans cette maladie ? Depuis plusieurs années, des scientifiques de l’IRSN mènent des recherches pour répondre à cette question et proposer des thérapies.
Le cancer est la seconde cause de décès dans le monde et chaque année environ 380 000 nouveaux cas sont diagnostiqués en France. La radiothérapie est un traitement incontournable pour le soigner. Le défi des radiothérapeutes est d’obtenir un compromis optimal entre le contrôle de la tumeur et la préservation du tissu sain présent dans la zone irradiée, aussi appelé « rapport risque/bénéfice ». Malgré cela, 90 % des patients soignés par radiothérapie pour un cancer pelvien décrivent des changements importants de leurs habitudes intestinales, causées par l’exposition aux rayonnements ionisants de cette région. Cette maladie, dénommée pelvic radiation disease en anglais (PRD), correspond à des problèmes fonctionnels, notamment digestifs. Ils peuvent être modérés à sévères et transitoires ou chroniques. La conséquence est une dégradation considérable de la qualité de vie des patients avec, pour les cas les plus graves, des hospitalisations fréquentes.
Améliorer la prise en charge des patients
Le nombre de cas de PRD est aujourd’hui élevé, supérieur à celui de certaines maladies inflammatoires chroniques de l’intestin – maladie de Crohn ou rectocolite hémorragique. À l’IRSN, depuis plusieurs années, une équipe de recherche du laboratoire de radiobiologie des expositions médicales de Fontenay-aux-Roses (Hauts-de-Seine)1 tente de comprendre s’il serait possible d’empêcher ou de soigner la PRD en jouant sur le microbiote intestinal. Pour cela, ils se sont associés à des experts en microbiologie de l’Institut national de recherche pour l’agriculture, l’alimentation et l’environnement (Inrae), à Jouy-en-Josas (Yvelines) et Marseille2& 3 (Bouches-du-Rhône). Le microbiote intestinal, plus connu sous le nom de « flore intestinale », est l’ensemble des micro-organismes – bactéries, archées, virus, champignons – hébergés naturellement dans le tube digestif, lui-même constituant l’écosystème le plus peuplé et diversifié de la planète. Au sein de cet écosystème digestif, le microbiote est considéré comme un organe fonctionnel au service du corps humain afin d’assurer sa santé. Il joue un premier rôle majeur : éviter la pénétration dans l’organisme d’agents microbiens pathogènes. Des mesures effectuées chez l’homme suggèrent que la PRD est associée à une altération du microbiote, proportionnelle à la sévérité de la maladie. Pour limiter les séquelles dont souffrent les patients atteints de la PRD, plusieurs options thérapeutiques impliquant une action sur cet écosystème pourraient être envisagées (voir infographie).
L’épithélium est protégé
Une alimentation équilibrée et variée mais riche en fibres, l’administration de prébiotiques – composés favorisant les bactéries bénéfiques –, de probiotiques, ou même le transfert de microbiote fécal sain (TMF), pourraient empêcher ou limiter des modifications de la quantité et de la qualité des micro-organismes intestinaux. À l’IRSN, deux thèses se sont déjà intéressées à cette problématique. La première (2016-2020) est portée par Alexia Lapière, ingénieure diplômée de l’école de biologie industrielle de Cergy-Pontoise (Val d’Oise). Elle s’est intéressée à l’utilisation thérapeutique de certaines bactéries intestinales correspondant à des probiotiques dits « de nouvelle génération ». Son travail mené chez le rat montre que l’administration de Faecallibacterium prausnitzii – une bactérie dont l’abondance est diminuée chez les patients atteints de PRD – protège l’épithélium intestinal de l’irradiation de façon transitoire. Comment pourrait-on alors orienter le geste thérapeutique pour une meilleure efficacité à long terme ? Faut-il identifier un cocktail de probiotiques de nouvelle génération plus efficace par rapport à l’administration seule de Faecallibacterium prausnitzii, ou carrément empêcher les modifications du microbiote soit par l’alimentation soit de façon plus drastique par un TMF ? Pour répondre à cette question il est indispensable d’identifier les différents micro-organismes pouvant être bénéfiques dans la lutte contre les effets de l’irradiation sur nos intestins. C’est dans cette perspective qu’une deuxième thèse (2019-2023) est menée par Mallia Geiger, pharmacienne de la faculté Philippe-Maupas, à Tours (2019-2023). Le séquençage de la totalité du génome des bactéries du microbiote donne une vision nouvelle de l’impact temporel de l’irradiation sur leurs capacités fonctionnelles, notamment métaboliques. Certaines voies métaboliques, au sein d’un groupe spécifique de bactéries, sont altérées après irradiation. Cet effet est directement corrélé à la sévérité des dommages du côlon.
Comprendre les mécanismes d’action du microbiote

Ces bactéries et leurs voies métaboliques constituent une nouvelle cible thérapeutique potentielle pour la PRD. L’utilisation d’un régime alimentaire spécifique riche en fibres est actuellement testée à l’IRSN dans le but d’empêcher ou de limiter les modifications fonctionnelles des bactéries d’intérêt. Cela fait l’objet d’une troisième thèse commencée début novembre 2023 et prise en charge par Calixte Cottineau, ingénieur diplômé de l’école de biologie industrielle de Cergy-Pontoise. Ce travail a comme finalité de participer à une meilleure compréhension des mécanismes d’action du microbiote sur notre santé et de proposer, à terme, des stratégies thérapeutiques de la PRD par l’alimentation.
1. https://www.irsn.fr/recherche/laboratoire-radiobiologie-expositions-med…
2 et 3. Université Paris-Saclay, Institut national de recherche pour l’agriculture, l’alimentation et l’environnement (Inrae), MetaGenoPolis (MGP) et AgroParisTech, Micalis, Jouy-en-Josas.
4. C2VN, Institut national de recherche pour l’agriculture, l’alimentation et l’environnement (Inrae), Inserm, Aix-Marseille Université, Marseille.
3 QUESTIONS À… Joël Doré, Institut Micalis

Où en sont les recherches sur le microbiote intestinal ?
Chaque microbiote intestinal compte en moyenne 300 espèces de microbes, ce qui correspond à 600 000 gènes. Nos cellules vivent en symbiose avec ce microbiote qui leur apporte des fonctions protectrices : régulation immunitaire, barrière intestinale, etc. Un défi est d’explorer précisément cet écosystème chez un grand nombre d’individus en bonne santé, en particulier les fonctions des gènes microbiens, afin de mieux comprendre comment ses altérations peuvent mener à l’apparition de différentes pathologies. C’est tout l’enjeu du projet de recherche Le microbiote français – Le French Gut.
Peut-on envisager d’agir sur le microbiote pour soigner ?
Absolument. Le transfert de microbiote fécal est une possibilité. Il consiste à introduire les selles de personnes saines dans le système digestif d’un patient pour restaurer son microbiote intestinal. À ce jour, il est au stade de la recherche, sauf pour les infections bactériennes récidivantes à Clostridioides difficile, dans lesquelles son utilisation permet de guérir 90 % des malades. Une autre option est l’utilisation de cocktails de composés actifs (molécules et/ou souches bactériennes) pour préserver l’écosystème intestinal. L’alimentation est également un bon levier pour moduler la composition microbienne de l’intestin.
Quel est l’intérêt de ces approches pour soigner la pelvic radiation disease (PRD), une maladie qui peut survenir après une radiothérapie ?
La radiothérapie s’accompagne d’une altération de la couche de mucus protectrice de l’intestin. Cela favorise un état inflammatoire et une altération du microbiote intestinal menant à un état critique parfois irréversible. Or un retour à une situation normale pourrait justement être favorisé par ces approches thérapeutiques : l’alimentation, l’utilisation de cocktails de probiotiques et/ou le transfert du microbiote fécal.
* Institut national de recherche pour l’agriculture, l’alimentation et l’environnement
AILLEURS - Le microbiote impliqué dans de très nombreuses maladies
Obésité, anxiété liée au stress, dépression, diabète, maladies inflammatoires chroniques de l’intestin… La littérature scientifique permet aujourd’hui de dégager des points communs à de nombreuses maladies chroniques présentes dans nos sociétés modernes. Le mécanisme fait à chaque fois intervenir au minimum un phénomène d’inflammation associé à une altération du microbiote, que l’on appelle la « dysbiose ».
Dans le cas de l’anxiété par exemple, les patients produisent du cortisol en excès, ce qui engendre une perméabilité intestinale et de l’inflammation. Dans le même temps, ils présentent un microbiote altéré. Cette altération peut être en partie liée à une alimentation occidentale riche en graisse animale, en sucres rapides et pauvre en fibres, tendant à fragiliser l’équilibre de l’écosystème intestinal. Il y a un risque d’emballement du système : le microbiote altéré et la perméabilité intestinale favorisent l’inflammation et le stress oxydant qui le fragilisent en retour. Restaurer l’équilibre de la flore intestinale – par une alimentation méditerranéenne plus riche en fibres ou par l’apport de bactéries régulatrices et de molécules antioxydantes – constitue un levier intéressant pour prévenir ou agir sur ces maladies.
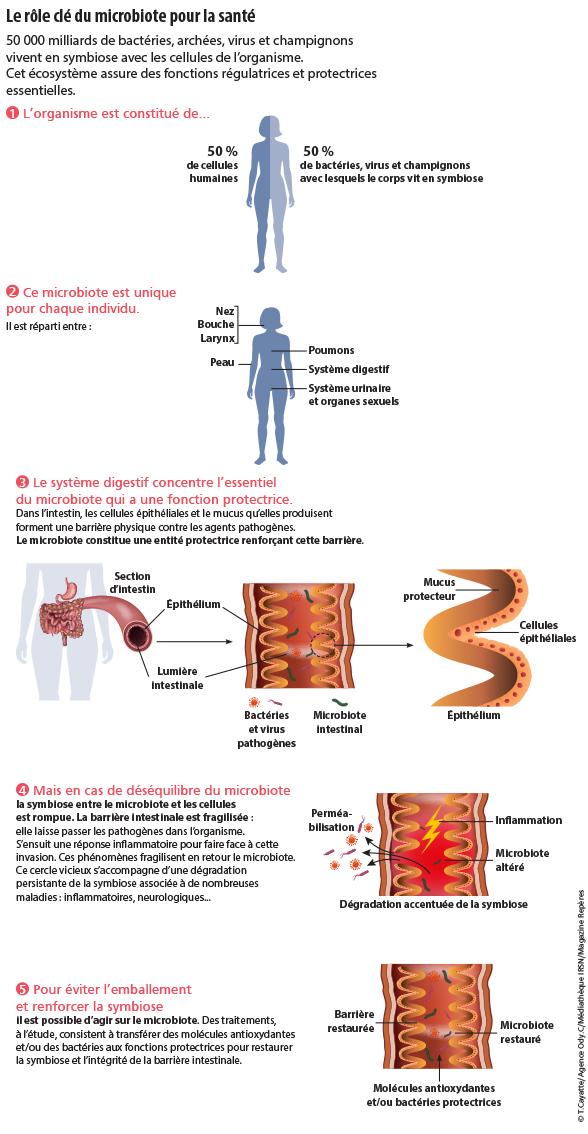
INFOGRAPHIE - Le rôle clé du microbiote pour la santé
50 000 milliards de bactéries, archées, virus et champignons vivent en symbiose avec les cellules de l’organisme.
Cet écosystème assure des fonctions régulatrices et protectrices essentielles.
Article publié en avril 2024